
LESŐHARCSA (SILURUS GLANIS) IVADÉK BAKTERIÁLIS FERTŐZÉSÉNEK DIAGNOSZTIZÁLÁSA ÉS KEZELÉSE: ESETTANULMÁNY
Eszterbauer Edit1,*, Zsigmond Gergely1, Bertyné Hardy Tímea1, Rónai Zsuzsanna2
1MTA ATK Állatorvos-tudományi Intézet, 1143 Budapest, Hungária krt. 21., *e-mail: eszterbauer.edit[kukac]agrar.mta.hu
2NÉBIH Állat-egészségügyi Diagnosztikai Igazgatóság, 1143 Budapest, Tábornok u. 2.
Kivonat
Bevezetés
Tógazdaságokban a környezeti hatásra, táplálék minőségre és kórokozókra igen érzékeny lesőharcsa (Silurus glanis) ivadék állományokban a táplálkozás megkezdését követően gyakran jelentkezik elhullás, melynek számos oka lehet. Gyakori kórokozók az egysejtű élősködők, köztük is a darakórt okozó Ichthyophthirius multifiliis (Herczeg és mtsai, 2017). A nem megfelelő táplálás is az elhullás elsődleges okai között szerepel. Gyakran fordul elő bélgyulladás, amit nem ritkán másodlagosan megtelepedő, anaerob baktériumok okoznak a tápra szoktatás időszakában. A tógazdasági haltenyésztésben a fakultatív patogén vízi baktériumok is igen komoly problémát okozhatnak, amennyiben nem megfelelő környezeti tényezők, vagy gyengébb egyedek jelenlétében az állomány legyengül és megbetegszik (Molnár & Baska, 2017).
Jelen tanulmányban egy hazai tógazdaságban előforduló esetet ismertetünk, kitérve a diagnosztikai módszerek és terápia részleteire.
Anyag és módszer
A tógazdaságban a lesőharcsa ivadék az első néhány napban probléma nélkül felvette a magas fehérjetartalmú starter tápot, azonban a kelés után 4-5 nappal számottevő elhullás jelentkezett. Az átlagosnál nagyobb meleg miatt a keltetőházban a víz hőmérséklete napközben elérte a 26°C-ot.
A laboratóriumba szállított, betegség tüneteit mutató egyedeket átfogó parazitológiai és kórtani vizsgálatnak vetettük alá. A hasüregből mintát vettünk, amit Columbia táptalajra oltottunk ki bakteriológiai vizsgálat céljából, és 25°C-on inkubáltuk 24 órán keresztül. Az izolált baktérium törzset metilénkék festés utáni mikroszkópos vizsgálattal, és API 20 NE biokémiai teszttel azonosítottuk. A baktérium törzset tovább oltottuk Müller-Hinton táptalajra, valamint vizsgáltuk antibiotikum rezisztenciáját. A feltételezett kórokozó azonosítása mellett a környezeti paraméterek vizsgálatára, különösen a vízhőmérsékletre kiemelt hangsúlyt fektettünk.
Eredmények és következtetések
A boncolásos vizsgálat során a hasüregben bevérzések voltak láthatóak, melyek a bélfalra koncentrálódtak. A hasüregben enyhe fokú folyadék felhalmozódás volt tapasztalható. A kopoltyúra, bőrre, és belső szervekre kiterjedő parazitológiai vizsgálat élősködő jelenlétét nem mutatta ki. A béltartalom vegyes takarmányozásra utalt; a táp mellett zooplankton alkotta a néhány napos ivadék táplálékát.
A bakteriológiai vizsgálat során a hasüregből magas csíraszámban, és gyakorlatilag színtenyészetben fényes, szürkésfehér, igen gyors növekedésű baktériumtelepeket izoláltunk. A rövid, pálca alakú baktériumokat a biokémiai tesztek alapján nagy bizonyossággal Vibrio cholerae törzsként azonosítottuk. A differenciáló táptalajra való átoltás ezt megerősítette. A Gram-negatív V. cholerae baktérium elsősorban a kolera kórokozójaként ismert, azonban a humán megbetegedést csak az O1-es és O139-es szerotípusba tartozó törzsek okozzák. A legtöbb, nem-O1 szerotípusú V. cholerae törzs vízi környezetben él, néhány törzsük fakultatív halpatogén, vagyis képes megbetegedést okozni legyengült állományban, és/vagy nem megfelelő tartási körülmények között (Woo és mtsai, 2007). Austin & Austin (2007) fertőzött aranyhalakban mutatta ki, hogy a fakultatív patogén V. cholerae törzs szeptikémiát, valamint pontszerű bevérzéseket okozott a halak belső szerveiben.
Egy nappal a vizsgálat megkezdése után már látható volt, hogy a magas, >25°C-os hőmérséklet rendkívül kedvező a baktérium szaporodásának, ezért javasoltuk a keltetőházi befolyóvíz hőmérsékletének csökkentését. A halgazdaság munkatársai kútvíz betáplálásával 23°C-ra csökkentették a vízhőmérsékletet. Az elhullás mértéke ennek hatására csökkent, és a halak étvágya visszatért.
Az elhullás jelentkezése utáni 3. napon a rezisztogram eredmény már rendelkezésre állt, és az ivadék állomány kezelése megkezdhető volt. A gátlási gyűrű mérete alapján az izolált baktérium törzs flumequine (FLM), enrofloxacin (ENR), florfenicol (FFC) és doxycyclin (DO) antibiotikumokra volt egyértelműen érzékeny (1. ábra).
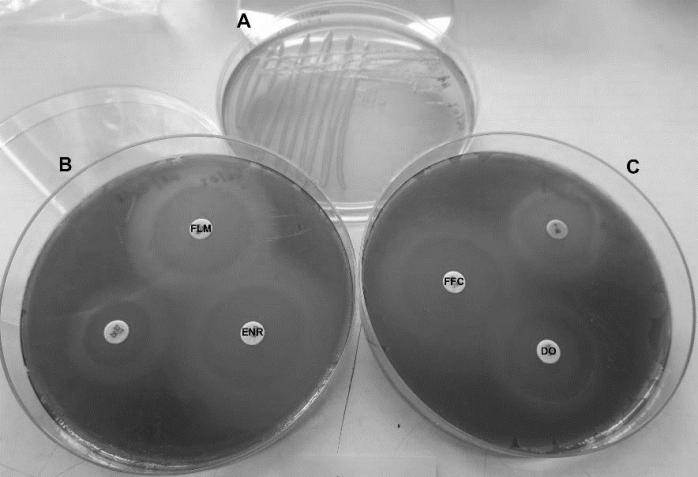
1. ábra: Lesőharcsa ivadékból izolált Vibrio cholerae törzs tenyészete Müller-Hinton táptalajon 24 óra inkubáció után 25°C-on (A). Az izolátumon végzett antibiotikum rezisztencia teszt eredménye (rezisztogram) Columbia táptalajon (B és C).
A rezisztogram figyelembevételével és tekintettel arra, hogy a bakteriális fertőzés igen intenzív volt az érintett állományban, állatorvosi felügyelet mellett flumequine kezelés történt gyógytáp formájában 10 mg/ttkg dózisban, 7 napon át. Az elhullás már a kezelés 2. napján megállt, és a kezelés után sem volt további számottevő pusztulás. Az antibiotikum kezelés után, a tápos etetést javasoltuk kiegészíteni fagyasztott zooplankton eleséggel, az ivadék bélflórájának regenerálása céljából.
Javaslatok
Az első tünetek jelentkezésekor a gyors reagálás elengedhetetlen. A negatív környezeti hatás megszüntetése elsődleges fontosságú, és az állomány gyógyszeres kezelését - amennyiben az állategészségügyileg indokolt - minél hamarabb meg kell kezdeni. A gyakori antibiotikum rezisztencia miatt azonban az antibiotikumos kezelést minden esetben meg kell előzze a kórokozó baktériumtörzs izolálása és antibiotikum rezisztenciájának vizsgálata (Zsigmond és mtsai, 2017).
Kulcsszavak: elhullás, Vibrio spp., kórokozó izolálás, biokémiai teszt, rezisztogram, antibiotikum kezelés
Köszönetnyilvánítás
Köszönjük a halgazdaság munkatársainak a gyors reagálást és az együttműködő hozzáállást, mellyel segítették munkánkat és hozzájárultak a kezelés sikerességéhez.
Irodalom
Austin B. and Austin DA. 2007. Bacterial fish pathogens: Diseases of farmed and wild fish. Springer Netherlands. p. 552. ISBN 978-1-4020-6068-7
Herczeg D., Sipos D., Dán Á., Loy C., Kallert D.M., Eszterbauer E. 2017. The effect of dietary immunostimulants on the susceptibility of common carp (Cyprinus carpio) to the white spot parasite, Ichthyophthirius multifiliis. Acta Vet. Hung. 65, 517-530.
Molnár K., Baska F. 2017. Halbetegségek. Magyar Állatorvosi Kamara, Budapest, 2017. p. 167. ISBN 9789638852281
Zsigmond G., Rónai Zs., Rigler E., Sipos D., Balog A., Katics M., Hoitsy Gy., Eszterbauer E. 2017. Aeromonas spp. okozta bőrfekélyesedés kezelési lehetőségei a gyakorlatban. Halászat 110(2), 26-31.
Woo P.T.K., Bruno D.W. (Eds.), 2011. Fish Diseases and Disorders, 2 edition. ed. CABI, Wallingford, UK; Cambridge, MA. p. 944. ISBN: 978-1845935542
Programajánló
Hírek
Tisztelt Látogatók!
A hazai agrár-felsőoktatás szükséges megújulásának mérföldköve az alapítványi fenntartású Magyar Agrár- és Élettudományi Egyetem (MATE) létrejötte, amely 2021. február 1-től 5 campuson, több mint 13 ezer hallgató számára fogja össze a dunántúli és közép-magyarországi élettudományi és kapcsolódó képzéseket. Az intézményhez csatlakozik a Nemzeti Agrárkutatási és Innovációs Központ (NAIK) 11 kutatóintézete is, így az új intézmény nem csupán egy oktatási intézmény lesz, hanem az ágazat szellemi, szakpolitikai és innovációs központjává válik, amely nagyobb mozgásteret biztosít a képzések, a gazdálkodás és szervezet modernizálásához, fejlesztéséhez. Az összeolvadással magasabb fokozatra kapcsolunk, a kutatói és egyetemi szféra szorosabban fonódik majd össze, aminek következtében még több érdekes, izgalmas kutatás-fejlesztés születhet majd az agrárium területén.
Kérjük, kövesse tevékenységünket a jövőben is a www.uni-mate.hu honlapon!
A szokásostól eltérően az idei évben ősszel, október 03-04 között került megrendezésre az Ultrabalaton csapatversenye. NAIK-os csapat az idei évben állt először rajthoz a 14. alkalommal kiírt versenyen.


