
A BALATONI KŐSÜLLŐ (SANDER VOLGENSIS) HÍMIVARSEJT MINŐSÉGÉNEK ÉS MÉLYHŰTÉSÉNEK VIZSGÁLATA
NAGY Borbála1*, BERNÁTH Gergely1, VÁRKONYI Levente1, FODOR Ferenc2, KOLTAI Tamás2, BODNÁR Ádám2, MOLNÁR József1, LÁNG Levente Zete1, IZSÁK Tibor1, STASZNY Ádám1, FERINCZ Árpád1, BIRKÓ-SULYOK Zita Katalin1, URBÁNYI Béla1, SZÁRI Zsolt2, BOKOR Zoltán1
1Szent István Egyetem, Mezőgazdaság- és Környezettudományi Kar, Akvakultúra és Környezetbiztonsági Intézet, Halgazdálkodási Tanszék , Gödöllő, Páter Károly út 1./Agárd, nagy.borbala[kukac]szie.hu
2Balatoni Halgazdálkodási Nonprofit Zrt., Siófok, Horgony u.1.
Kivonat
Bevezetés
A kősüllő egy Közép- és Kelet-Európában fellelhető halfaj. Húsának minősége közeli
rokonáéhoz, a süllőéhez (Sander lucioperca) hasonlóan kiváló. Állománya az utóbbi két évtizedben jelentős mértékben lecsökkent (Holcik J. 2003). A jelentős horgász- és halászfogások „veszteségeit” tenyésztésből származó kihelyezésekkel lehetne pótolni (Szabó et al. 2009). Mesterséges szaporítására vonatkozóan igen kevés irodalmi adat áll rendelkezésre, így annak további vizsgálata elengedhetetlen (Bokor et al. 2007). A spermamélyhűtés egyszerűbbé és költséghatékonyabbá teheti a szaporítási és nevelési folyamatokat (Bokor et al. 2019). Ezen felül lehetővé teszi a kiváló minőségű ivarsejtek megőrzését, illetve génbankok létrehozását (Bernáth et al. 2018). A hímivartermék megfelelő minősége elengedhetetlen fontosságú a sikeres mélyhűtés és szaporítás elérése érdekében (Cosson J. 2019). A kősüllő mesterséges termékenyítésével eddig nagyon kevesen foglalkoztak. A faj spermamélyhűtéséről tudomásunk szerint csak egy tanulmányban írnak (Bokor et al. 2007). Kísérletünk célja a kősüllő sperma mélyhűtési technológiák fejlesztése volt, melyek alapjául szolgálnak a tervezett szaporítási vizsgálatoknak.
Anyag és módszer
A kísérleteinkhez a tejes állományt a Balatoni Halgazdálkodási Nonprofit Zrt. biztosította. A vizsgálatokat a Szent István Egyetem, Halgazdálkodási Tanszékének telephelyén található haltartó infrastruktúrájában végeztük. Az oltást megelőzően a halakat 2-fenoxi-etanolt (99%, 0,4 ml/l) tartalmazó vízben bódítottuk. A spermáció indukálásához hipofízis kezelést alkalmaztunk. Az ivarterméket a halak hasfalának felmetszését követően a herék préselésével nyertük ki. A sejtek progresszív motilitását a friss és a mélyhűtött mintákban egyaránt számítógépes spermavizsgáló rendszerrel (CASA, Computer-assisted spermanalysis, Sperm VisionTM v. 3.7.4., Minitube of America, Venture Court Verona, Egyesült Államok) végeztük. A sejtek aktiválásához egy 50 mM NaCl tartalmú, 30 mM Tris-sel pufferelt oldatot használtunk (pH: 8,0±0,2, Bokor et al. 2019), melyhez 0,01 g/ml BSA-t (bovine serum albumin, szarvasmarha szérum albumin) adtunk. Vizsgálataink során a mélyhűtéshez kétféle hígítót alkalmaztunk. Védőanyagként 10% metanolt használtunk. A kísérletek folyamán minden alkalommal 1:9 (sperma:hígító+védőanyag) arányban hígítottuk a spermát. A mintákat 0,25, vagy 0,5 ml-es műszalmába töltöttük. A fagyasztáshoz két különböző mélyhűtési módszert alkalmaztunk. A programozható fagyasztó berendezésben (CRF, Controlled rate freezer, IceCube 14s, IceCube Series v. 2.24, Sy-Lab, Neupurkersdorf, Ausztria) történő mélyhűtés során egy előre megírt program (hűtési sebesség: 56 °C/perc) alapján fagyasztottuk a műszalmákat. A polisztirol dobozban történő mélyhűtés alkalmával 3 cm-en a nitrogén gőzében hűtöttük a mintákat, a folyamat 3 percig tartott (Bokor et al. 2019; Horváth et al. 2003). A sperma felolvasztását 40 °C-os vízfürdőben (ThermoHaake P5, Thermo Electron Corp, Waltham, Massachusetts, Egyesült Államok) végeztük.
Kísérleti terv
Az első kísérlet során 20 hímtől nyert ivarterméket vizsgáltunk. A sperma mintákat 1:1000 hígítási arányban hígítottuk. A sejtszám meghatározáshoz sejtszámláló kamrát (Bürker típus, Neubauer, Marienfield Superior, Paul Marienfield GmBH & CO. KG, Németország) használtunk. Fénymikroszkóp segítségével minden mintáról 20 db képet készítettünk, ezt követően egy Image J nevű programmal (Image J for Windows, National Institutes of Health, Egyesült Államok) számoltuk le a sejteket. A ml-re jutó sejtszámot (N) az alábbi képlet szerint határoztuk meg, ahol X az átlagos sejtszámot jelöli: N=X × 25 × 10 × 1000 × 1000 (Bokor Z. 2009).
Következő vizsgálatunkban a hím (N=4) egyedek heréjének kioperálása során nyert spermát mélyhűtöttük kétféle hígítóval. Az ivarterméket csuka (150 mM glükóz, 75 mM NaCl, 30 mM KCl, 1 mM Na2HPO4 × 12H2O, 1 mM MgCl2 × 6H2O, 1 mM CaCl2 × 2H2O, 20 mM Tris, és 0,5% BSA, pH: 8±0,2, Molnár et al. 2020) és módosított Tanaka hígító (137 mM NaCl, 76,2 mM NaHCO3, Bernáth et al. 2015b) felhasználásával 0,5 ml-es műszalmákban mélyhűtöttük polisztirol dobozban. A friss és a mélyhűtött minták felolvasztás utáni motilitását egyaránt rögzítettük.
Utolsó vizsgálatunkban oltást követően 24 órával 5 kősüllő tejes heréjét operáltuk ki és préseltük össze, majd az így nyert sperma motilitását CASA rendszerrel rögzítettük. A módosított Tanaka oldattal kihígított ivarterméket 0,25 ml-es és 0,5 ml-es műszalmákba töltöttük. A mintákat programozható fagyasztó berendezésben mélyhűtöttük. Olvasztást követően rögzítettük a minták motilitását.
Eredmények és következtetések
Első vizsgálatunkban 20 kősüllőtől nyert sperma sejtkoncentrációját állapítottuk meg, ami alapján 1 ml spermában átlagosan 3×1010 sejt található. Második vizsgálatunkban a friss (40±10%), a módosított Tanaka (41±13%), valamint a csuka (24±6%) hígítóval mélyhűtött minták olvasztás utáni progresszív motilitása között nem találtunk szignifikáns különbséget (1.ábra).
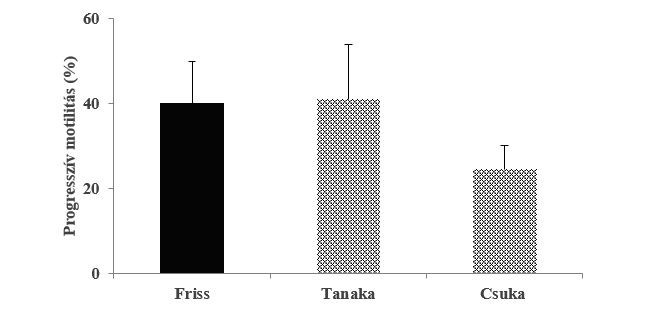
1. ábra Két különböző hígító összehasonlítása során mért progresszív motilitás (N=4). Az ábrán átlagértékek és a hozzájuk tartozó szórások láthatók.
A friss minták (23±19%) és a két különböző méretű műszalma (0,25 ml: 31±6%, 0,5 ml: 27±9%) használatával mélyhűtött minták progresszív motilitása között nem volt szignifikáns különbség (2. ábra).
![]()
2. ábra A CRF-ben mélyhűtött 0,25 ml-es és 0,5 ml műszalmák összehasonlítása során mért progresszív motilitás (N=5). Az ábrán átlagértékek és a hozzájuk tartozó szórások láthatók.
A sejtsűrűség meghatározásra kősüllő esetén tudomásunk szerint eddig nem történt vizsgálat, rokon fajoknál azonban igen. A süllő ivartermék sejtkoncentrációját Bokor et al. vizsgálta 2012-ben, ahol 1 ml spermában 8,3×109 sejtszámot határozott meg. Alavi et al. (2007) sügérnél végzett sűrűség meghatározást, 1 ml hímivartermékben 2,9×1010 spermasejtet állapított meg. Ehhez hasonló a kősüllő sperma sejtszáma, 3×1010 sejt/ml, melyet vizsgálatunkban mértünk. A korábban más fajoknál eredményesen tesztelt oldatok közül (módosított Tanaka hígító-Bernáth et al. 2015a, Csuka hígító-Molnár et al. 2020), a módosított Tanaka hígító bizonyult a legalkalmasabbnak a kősüllő sperma fagyasztása során. A 0,25 (31±6%) és 0,5 (27±9%) ml-es műszalmák mélyhűtési vizsgálatában az felolvasztást követően nem találtunk szignifikáns különbséget a friss (23±19%) és mélyhűtött minták között. Dietrich 2016-os vizsgálatában 0,25 ml-es műszalmában mélyhűtött csuka sperma felhasználásával 90 %-os termékenyülést ért el, megvizsgálva a friss és mélyhűtött minták motilitását (magasabb mint 60%) szintén nem talált szignifikáns különbséget. Amennyiben korlátozott mennyiségű ivartermék áll rendelkezésre a 0,25 ml-es műszalma, más fajokhoz hasonlóan, a kősüllő sperma mélyhűtésére is hatékonyan alkalmazható.
Összefoglalás
Tudomásunk szerint elsőként határoztuk meg a kősüllő sperma sejtkoncentrációját 20 tejes egyed felhasználásával. A vizsgált hígítók összehasonlítása során a módosított Tanaka bizonyult hatékonyabbnak a kősüllő sperma mélyhűtéséhez. A 0,25 ml-es és 0,5 ml-es műszalmák összehasonlítása során kapott eredmények alapján a két különböző méretű műszalma egyaránt használható kősüllő sperma mélyhűtésre. A polisztirol doboz terepi körülmények között akár közvetlenül a vízparton, a programozható fagyasztó berendezés a keltetőházi szaporítás során teheti lehetővé a kősüllő sperma fagyasztását a közeljövőben.
Kulcsszavak: kősüllő, sejtsűrűség, spermamélyhűtés, CASA
Köszönetnyilvánítás
A kísérletek végrehajtásához a GINOP-2.3.2-15-2016-00004, az Európai Halászati Alap, Halászati Operatív Program III. tengelye (“Európai Halászati Alap: a megújuló halászatért” - az Európai Unió és Magyarország támogatásával), és az EFOP-3.6.3-VEKOP-16-2017-00008 pályázatok járultak hozzá. A projekt az Európai Unió támogatásával, az Európai Szociális Alap társfinanszírozásával valósult meg. A kutatás továbbá Bernáth Gergely Bolyai János Kutatási (BO/00508/18/4) Ösztöndíjának és Az Innovációs és Technológiai Minisztérium ÚNKP-19-4 kódszámú Új Nemzeti Kiválóság Programjának szakmai támogatásával készült.
Irodalom
Alavi S.M.H., Rodina M., Policar T., Kozak P., Psenicka M., Linhart O. 2007. Semen of Perca fluviatilis L.: Sperm volume and density, seminal plasma indices and effects of dilution ratio, ions and osmolality on sperm motility. Theriogenology, 68, 276–283.
Bernáth G., Żarski D., Krejszeff S., Palińska‐Żarska K., Bokor Z., Król J., Kollár T., Kucharczyk D., Urbányi B., Horváth Á. 2015a. Optimization of conditions for the cryopreservation of Eurasian perch (Perca fluviatilis Linnaeus, 1758) sperm. Journal of Applied Ichthyology, 94–98.
Bernáth G., Bokor Z., Kása E., Várkonyi L., Hegyi Á., Kollár T., Urbányi B., Zarski D., Ifj. Radóczi J., Horváth Á. 2015b. Comparison of two different methods in the cryopreservation of Eurasian perch (Perca fluviatilis) sperm. Cryobiology, 70, 76–78.
Bernáth G., Csenki Zs., Bokor Z., Várkonyi L., Molnár J., Szabó T., Staszny Á., Ferincz Á., Szabó K., Urbányi B., Pap L.O., Csorbai B. 2018. The effects of different preservation methods on ide (Leuciscus idus) sperm and the longevity of sperm movement. Cryobiology, 81, 125–131.
Bokor Z. 2009. A harcsa (Silurus glanis) és a süllő (Sander lucioperca) sperma mélyhűthetőségének vizsgálata gyakorlati szempontok alapján. Doktori értekezés, SZIE Gödöllő, 102 p.
Bokor Z., Müller T., Bercsényi M., Horváth L., Urbányi B., Horváth Á. 2007. Cryopreservation of sperm of two European percid species, the Pike perch (Sander lucioperca) and the Volga pikeperch (S. volgensis). Acta Biologica Hungarica, 58, 199–207.
Bokor Z., Urbányi B., Horváth L., Müller T., Horváth Á.. 2012. Sperm Cryopreservation of Two European Predator Fish Species, the Pikeperch (Sander lucioperca) and the Wels Catfish (Silurus glanis). In: Katkov, I. (Ed.): Current Frontiers in Cryopreservation. InTech, 462, 253-268.
Bokor Z., Bernáth G., Várkonyi L., Molnár J., Láng L.Z., Tarnai-Király Zs., Solymosi E., Urbányi B. 2019. The applicability of large-scale sperm cryopreservation in wels catfish (Silurus glanis) optimized for hatchery practice. Aquaculture, 506, 337–340.
Cosson J. 2019. Fish sperm physiology: structure, factors regulating motility, and motility evaluation. In: Yusuf B. (Ed.): Biological Research in Aquatic Science, 11–36.
Holcik J. 2003. Changes in the fish fauna and fisheries in the Slovak section of the Danube River: a review. Annales de Limnologie - International Journal of Limnology, 39 (3), 177–195.
Horváth Á., Miskolci E., Urbányi B. 2003. Cryopreservation of common carp sperm. Aquatic Living Resources, 16, 5, 457–460.
Molnár J., Bokor Z., Várkonyi L., Izsák T., Füzes-Solymosi E., Láng Z.L., Csorbai B., Tarnai-Király Zs., Urbányi B., Bernáth G. 2020. The systematic development and optimization of large-scale sperm cryopreservation in northern pike (Esox lucius). Cryobiology, 4–9.
Szabó G., Müller T., Molnár T.G., Sudár G., Zake Z., Hancz Cs. 2009. Különböző takarmányadagok hatása a kősüllő (Sander volgensis Gmelin 1788) növekedésére és testösszetételére intenzív nevelés mellett. Acta Agraria Kaposváriensis, 17 (1), 37–46.
Várkonyi L., Bokor Z., Molnár J., Fodor F., Szári Zs., Ferincz Á., Staszny Á., Láng L.Z., Csorbai B., Urbányi B., Bernáth G. 2019. The comparison of two different extenders for the improvement of large–scale sperm cryopreservation in common carp (Cyprinus carpio). Reproduction in Domestic Animals, 54, 3, 639–645.
Programajánló
Hírek
Tisztelt Látogatók!
A hazai agrár-felsőoktatás szükséges megújulásának mérföldköve az alapítványi fenntartású Magyar Agrár- és Élettudományi Egyetem (MATE) létrejötte, amely 2021. február 1-től 5 campuson, több mint 13 ezer hallgató számára fogja össze a dunántúli és közép-magyarországi élettudományi és kapcsolódó képzéseket. Az intézményhez csatlakozik a Nemzeti Agrárkutatási és Innovációs Központ (NAIK) 11 kutatóintézete is, így az új intézmény nem csupán egy oktatási intézmény lesz, hanem az ágazat szellemi, szakpolitikai és innovációs központjává válik, amely nagyobb mozgásteret biztosít a képzések, a gazdálkodás és szervezet modernizálásához, fejlesztéséhez. Az összeolvadással magasabb fokozatra kapcsolunk, a kutatói és egyetemi szféra szorosabban fonódik majd össze, aminek következtében még több érdekes, izgalmas kutatás-fejlesztés születhet majd az agrárium területén.
Kérjük, kövesse tevékenységünket a jövőben is a www.uni-mate.hu honlapon!
A szokásostól eltérően az idei évben ősszel, október 03-04 között került megrendezésre az Ultrabalaton csapatversenye. NAIK-os csapat az idei évben állt először rajthoz a 14. alkalommal kiírt versenyen.


