Mikroalgák immunstimuláló hatásának vizsgálata in vitro és in vivo módszerekkel gazdasági szempontból fontos halfajokon
Ardó László1, Berecz Orsolya1, Szűcs Anita1, Dergez Ágnes2, Ughy Bettina3, Kóbori Ottilia2, Jeney Galina1, Jakabné Sándor Zsuzsanna1
1Nemzeti Agrárkutatási és Innovációs Központ, Halászati Kutatóintézet (NAIK-HAKI), 5540 Szarvas, Anna-liget u. 35. ardo.laszlo[kukac]haki.naik.hu
2Bay Zoltán Alkalmazott Kutatási Nonprofit Kft. Biotechnológiai Divízió (BAY-BIO), 6726 Szeged, Derkovits fasor 2. agnes.dergez[kukac]bayzoltan.hu
3Magyar Tudományos Akadémia, Szegedi Biológiai Központ, Növénybiológiai Intézet (MTA-SZBK), 6726 Szeged, Temesvári krt. 62. ughyb4[kukac]gmail.com
Kivonat
Bevezetés
A természetes immunválasz erősítése, más néven immunstimuláció, mint a betegségek megelőzésének egyik módszere kiemelt jelentőséggel bír a haltenyésztés intenzifikálásában (Sakai 1999). Az iparszerű, zárt akvakultúra rendszerekben a nagy mennyiségű egészséges ivadékállomány fenntartása és megfelelő táplálékának biztosítása a haltenyésztés egyik kritikus pontja. A betegségek megelőzésére használt antibiotikumok alkalmazására vonatkozóan az EU új szabályokat vezetett be; ezért nagyon fontos új, alternatív módszerek keresése a halbetegségek megelőzésére és gyógyítására (Dawood et al. 2018). A mikroalgák alkalmazásával történő immunstimuláció egy ilyen ideális megoldás lehet (Cerezuela et al. 2012; Messina et al. 2018). Ennek eredményeként a hal egy biztonságos, antibiotikum-maradvány mentes élelmiszerré válhat, amely egyben hozzájárul a környezetbe kijuttatott gyógyszer- és vegyszermaradványok csökkentéséhez is.
A 2017-ben indított projektben azt vizsgáljuk, hogy magyarországi édesvizekben előforduló mikroalgák alkalmasak-e nagy tömegű termelésére és tartalmaznak-e a hal számára olyan fontos bioaktív komponenseket, melyek szerepet játszhatnak a halnevelés korai szakaszában gyakori betegségek visszaszorításában. A projekten belül a NAIK-HAKI egyik feladata az algák immunstimuláló hatásának vizsgálata gazdasági szempontból fontos halfajokon, mely információk hozzájárulnak a mikroalgák szelekciójához.
Anyag és módszer
A partnereink által szelektált és nevelt algaizolátumokat (ST3i, ST4i, ST5i, ST6i, ST8i) először in vitro módszerekkel vizsgáltuk szivárványos pisztrángon (Oncorhynchus mykiss), pontyon (Cyprinus carpio) és süllőn (Sander lucioperca). A halak fejveséjéből gradiens centrifugálással fehérvérsejteket izoláltunk (Secombes 1990), amelyeket L-15 tápoldatban, 18 °C hőmérsékleten, mikrotiter lemezeken tenyésztettünk. A száraz tömeg alapján az algatenyészetekből L-15 tápoldat hozzáadásával 100; 20; 5 és 1 mg/l koncentrációjú hígításokat készítettünk. A fehérvérsejteket ezekkel a tápoldatokkal 48 (szivárványos pisztráng, süllő), illetve 72 (ponty) óráig inkubáltuk, majd fotometriás módszerrel mértük a sejtek respirációs aktivitását (szivárványos pisztráng, süllő) (Secombes 1990), illetve nitrogén-oxid termelését (ponty) (Green et al. 1982). Az in vitro teszteken kívül egy előzetes in vivo kíséreltet is végeztünk, amelyhez 449,5 ± 94,5 gramm egyedi átlagtömegű szivárványos pisztrángokat használtunk. Két csoportot állítottunk be, az egyiket 5% ST6i algát tartalmazó, a másikat alga nélküli táppal etettük 3 hétig. Az alga tartalmú tápot egy kereskedelmi táp és nedves alga biomassza elegyítésével készítettük konyhatechnikai eljárással. Az így kapott tápot hasonló módon etettük automata etetővel, mint a kontroll tápot. A halaktól fejvese- és vérmintát vettünk az etetés megkezdése előtt (induló minták) és a kísérlet végén (kezelt és kontroll minták). A fejvesemintákból fehérvérsejteket izoláltunk, amelyek respirációs (Secombes 1990) és fagocitáló aktivitását (Seeley et al. 1990) mértük. A vérmintákból izoláltuk a vérplazmát, amelyből a lizozimaktivitást (Sankaran és Gurnani 1972), az összes fehérje- és immunoglobulin-szintet határoztuk meg.
Eredmények és következtetések
A pisztrángokkal végzett in vitro kísérletben valamennyi vizsgált algakészítménynek volt olyan hígítása, amely statisztikailag szignifikáns (p<0,05) mértékben növelte a fehérvérsejtek respirációs aktivitását (1. ábra). Ezek jellemző módon az alacsonyabb koncentrációk (1 és 5 mg/l) voltak, a legmagasabb, 100 mg/l koncentráció néhány esetben szignifikáns csökkenést okozott. A süllővel végzett kísérletben is hasonló eredményeket kaptunk, a ponty esetében viszont jellemzően a magasabb (20 és 100 mg/l) koncentrációk növelték a fehérvérsejtek nitrogén-oxid termelését.
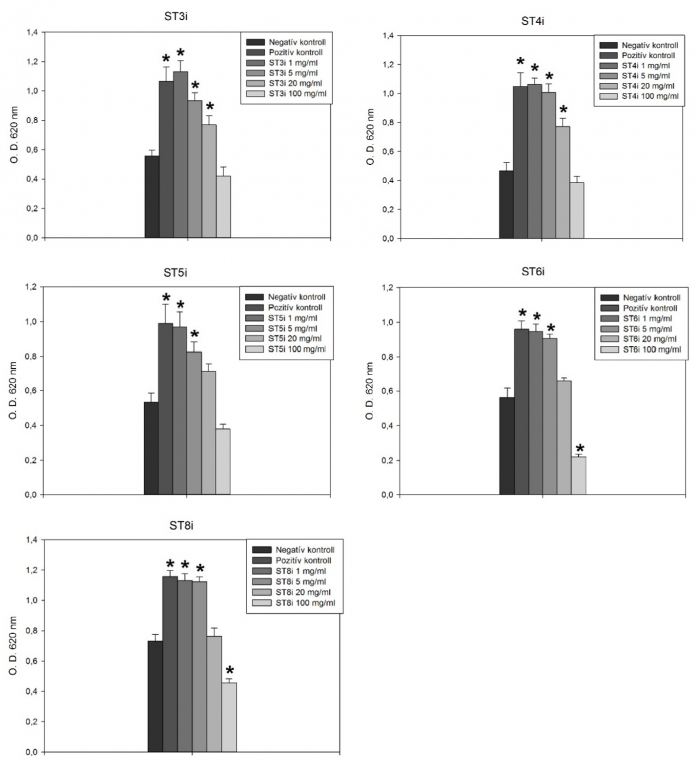
1. ábra: A vizsgált algakészítmények különböző hígításainak hatása a szivárványos pisztráng fejveséjéből izolált fehérvérsejtek respirációs aktivitására. *: szignifikáns (p<0,05) különbség a kontrollhoz képest.
Az ST6i algával szivárványos pisztrángokon végzett előzetes in vivo kísérletben a kísérlet végén a fehérvérsejtek respirációs aktivitása és a vérplazma lizozimaktivitása szignifikánsan (p<0,05) alacsonyabb volt a kezelt csoportban, mint a kontrollnál (2. ábra). A másik három vizsgált paraméterben nem volt jelentős mértékű különbség a két csoport között. A respirációs aktivitás és a lizozimaktivitás alacsonyabb szintje a kezelt csoportban az alga túladagolásával (túl magas dózis és/vagy túl hosszú etetési idő) magyarázható.
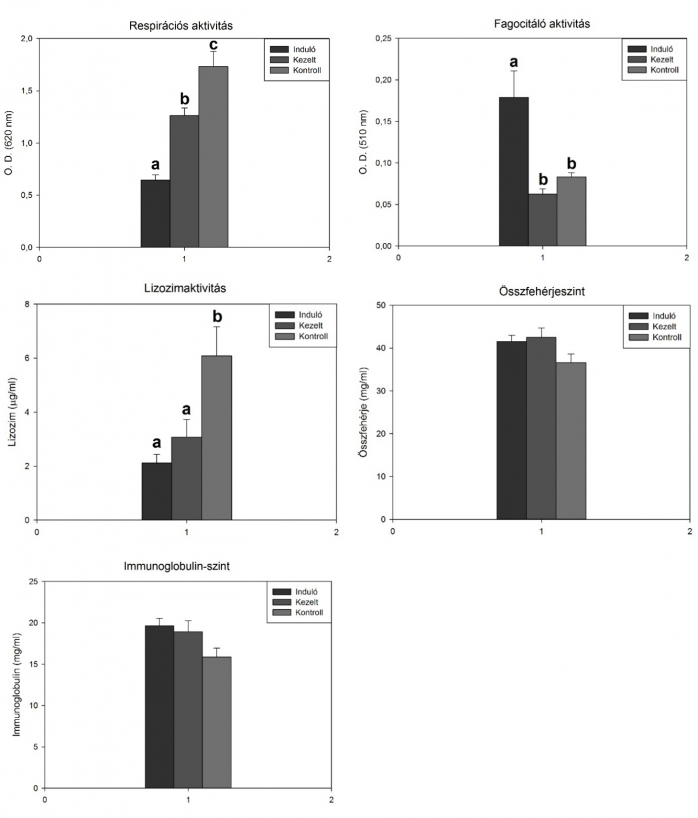
2. ábra: A természetes immunválasz jellemzőinek alakulása az ST6i algával (5%) szivárványos pisztrángokon végzett etetési kísérletben. A különböző betűk szignifikáns különbséget (p<0,05) jelentenek az egyes csoportok között.
Összefoglalás
Kutatómunkánk során új, eddig még nem alkalmazott mikroalga törzsek immunstimuláló hatását vizsgáltuk in vitro módszerekkel szivárványos pisztrángokból, süllőkből és pontyokból izolált fehérvérsejteken, illetve egy előzetes in vivo etetési kísérletet is végeztünk az ST6i alga 5%-os dózisával szivárványos pisztrángokon. Az in vitro kísérletekben valamennyi vizsgált algakészítménynek volt olyan koncentrációja, amely szignifikáns (p<0,05) mértékben javította a természetes immunválaszt. Az in vivo kísérlet végén a kezelt csoportban szignifikánsan (p<0,05) alacsonyabb volt a fehérvérsejtek respirációs aktivitása és a vérplazma lizozimaktivitása, mint a kontrollnál, amelynek oka az alga túladagolása lehetett. Az algák hatékony dózisának és alkalmazási idejének megállapításához további in vivo kísérletekre van szükség. Ezen kívül további in vitro kísérleteket is tervezünk az algakivonatok hatásmechanizmusának megállapítására.
Kulcsszavak: mikroalgák, immunstimuláció, természetes immunválasz
Köszönetnyilvánítás
A kísérleti munka a GINOP -2.3.2-15-2016-00058 „Immunstimuláló hatású és eddig nem alkalmazott mikroalga törzseken alapuló preventív célú takarmány kiegészítők hatékony termelése és intenzív halgazdaságokban történő hasznosítása” projekt keretei között az Európai Regionális és Fejlesztési Alap és Magyarország Kormánya támogatásával valósult meg.
Irodalom
Cerezuela R., Guardiola F. A., Meseguer J., Esteban M. A. 2012. Enrichment of gilthead seabream (Sparus aurata L.) diet with microalgae: effects on the immune system. Fish Physiology and Biochemistry 2012;38(6):1729-1739.
Dawood M. A. O., Koshio S., Esteban M. A. 2018. Beneficial roles of feed additives as immunostimulants in aquaculture: a review. Reviews in Aquaculture 2018;10(4):950-974.
Green L. C., Wagner D. A., Glogowski J., Skipper P. L., Wishnok J. S., Tannenbaum S. R. 1982. Analysis of nitrate, nitrite and [15N]nitrate in biological fluids. Analitical Biochemistry 1982;126:131-138.
Messina M; Bulfon C; Beraldo P; Tibaldi E; Cardinaletti G. 2019. Intestinal morpho-physiology and innate immune status of European sea bass (Dicentrarchus labrax) in response to diets including a blend of two marine microalgae, Tisochrysis luea and Tetraselmis suecica. Aquaculture 2019;500:660-669.
Sakai M. 1999. Current research status of fish immunostimulants. Aquaculture 1999;172:63-92.
Sankaran K. and Gurnani S. 1972. On the variation in the catalytic activity of lysozyme in fishes. Indian Journal of Biochemistry and Biophysics 1972;9:62-165.
Secombes C. J. 1990. Isolation of salmonid macrophages and analysis of their killing activity. In: Stolen J. S.; Fletcher, T. C.; Anderson, D. P.; Kattari S. L.; Rowley, A. F. (eds): Techniques in Fish Immunology 1990;1:137-154, SOS Publications, Fair Heaven, NJ, USA.
Seeley K. R.; Gillespie P. D; Weeks B. A. 1990. A simple technique for the rapid spectrophotometric determination of phagocytosis by fish macrophages. Marine Environmental Research 1990;30:123-128.
Programajánló
Hírek
Tisztelt Látogatók!
A hazai agrár-felsőoktatás szükséges megújulásának mérföldköve az alapítványi fenntartású Magyar Agrár- és Élettudományi Egyetem (MATE) létrejötte, amely 2021. február 1-től 5 campuson, több mint 13 ezer hallgató számára fogja össze a dunántúli és közép-magyarországi élettudományi és kapcsolódó képzéseket. Az intézményhez csatlakozik a Nemzeti Agrárkutatási és Innovációs Központ (NAIK) 11 kutatóintézete is, így az új intézmény nem csupán egy oktatási intézmény lesz, hanem az ágazat szellemi, szakpolitikai és innovációs központjává válik, amely nagyobb mozgásteret biztosít a képzések, a gazdálkodás és szervezet modernizálásához, fejlesztéséhez. Az összeolvadással magasabb fokozatra kapcsolunk, a kutatói és egyetemi szféra szorosabban fonódik majd össze, aminek következtében még több érdekes, izgalmas kutatás-fejlesztés születhet majd az agrárium területén.
Kérjük, kövesse tevékenységünket a jövőben is a www.uni-mate.hu honlapon!
A szokásostól eltérően az idei évben ősszel, október 03-04 között került megrendezésre az Ultrabalaton csapatversenye. NAIK-os csapat az idei évben állt először rajthoz a 14. alkalommal kiírt versenyen.



